Publikation des Jahres 2017
D. Tapken, T.B. Steffensen, R. Leth, L.B. Kristensen, A. Gerbola, M. Gajhede, F.S. Jørgensen, L. Olsen, and J.S. Kastrup (2017).
The low binding affinity of D-serine at the ionotropic glutamate receptor GluD2 can be attributed to the hinge region.
Scientific Reports 7: 46145.
doi: 10.1038/srep46145
Abstract
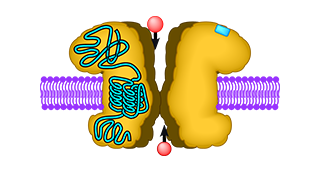
 Ionotrope Glutamatrezeptoren (iGluRs) sind Ionenkanäle, die für den Großteil der erregenden Signalweiterleitung im Gehirn verantwortlich sind. Sie werden im allgemeinen durch den Neurotransmitter Glutamat aktiviert, wobei einige zusätzlich Glycin oder D-Serin als Koagonisten benötigen. Die Aktivierung führt zur Öffnung des Ionenkanals, der den Einstrom von Na+ und in einigen Fällen auch Ca2+ ermöglicht. Für ein Mitglied der iGluR-Familie, GluD2, wurde bisher keine Aktivierung durch einen Liganden nachgewiesen, obwohl es Glycin und D-Serin mit geringer Affinität bindet. Mittels Elektrophysiologie an Oozyten, isothermer Titrationskalorimetrie und Molekulardynamiksimulationen haben wir untersucht, warum GluD2 D-Serin mit so geringer Affinität bindet. Wir konnten zeigen, daß die Region der Ligandenbindungsdomäne, die als Gelenk für die Konformationsänderung bei der Bindung von D-Serin dient, für die geringe Affinität verantwortlich ist. Mutiert man dieses Gelenk zu dem der mit hoher Affinität D-Serin bindenden Untereinheit GluN1, erhöht sich die D-Serin-Affinität von GluD2 erheblich.
Ionotrope Glutamatrezeptoren (iGluRs) sind Ionenkanäle, die für den Großteil der erregenden Signalweiterleitung im Gehirn verantwortlich sind. Sie werden im allgemeinen durch den Neurotransmitter Glutamat aktiviert, wobei einige zusätzlich Glycin oder D-Serin als Koagonisten benötigen. Die Aktivierung führt zur Öffnung des Ionenkanals, der den Einstrom von Na+ und in einigen Fällen auch Ca2+ ermöglicht. Für ein Mitglied der iGluR-Familie, GluD2, wurde bisher keine Aktivierung durch einen Liganden nachgewiesen, obwohl es Glycin und D-Serin mit geringer Affinität bindet. Mittels Elektrophysiologie an Oozyten, isothermer Titrationskalorimetrie und Molekulardynamiksimulationen haben wir untersucht, warum GluD2 D-Serin mit so geringer Affinität bindet. Wir konnten zeigen, daß die Region der Ligandenbindungsdomäne, die als Gelenk für die Konformationsänderung bei der Bindung von D-Serin dient, für die geringe Affinität verantwortlich ist. Mutiert man dieses Gelenk zu dem der mit hoher Affinität D-Serin bindenden Untereinheit GluN1, erhöht sich die D-Serin-Affinität von GluD2 erheblich.