Glaukom
Bei der Glaukomerkrankung kommt es zu einem chronischen Verlust retinaler Ganglienzellen und ihrer Axone, was mit einer Schädigung der Papille und des Gesichtsfeldes einhergeht. Ein erhöhter Augeninndruck ist einer der Hauptrisikofaktoren des Glaukoms, doch die genaue Pathogenese ist bisher unklar. Unter anderem werden mechanische Prozesse, ischämische Schäden, Exzitotoxizität oder immunologische Prozesse als Krankheitsauslöser diskutiert. Um die multifaktorielle Erkrankung nachzubilden und untersuchen zu können sind Modellsysteme notwendig.
EXPERIMENTELLES AUTOIMMUNES GLAUKOMMODELL
Zur Untersuchung möglicher druckunabhängiger Glaukommechanismen arbeitet unsere Gruppe mit einem sogenannten Experimentellen Autoimmunen Glaukommodell (EAG). In diesem wird durch Immunisierung mit okulären Antigenen (z.B. Sehnervenhomogenat, HSP27 oder S100B) ein Verlust von retinalen Ganglienzellen herbeigeführt.
Ursprünglich wurde das Modell an Ratten etabliert und erforscht. Um die Forschungsmöglichkeiten zu erweitern, wurde das Modell in Kooperation mit dem Lehrstuhl für Zellmorphologie und Molekulare Neurobiologie (Ruhr-Universität Bochum) vom Modelltier Ratte auf die Maus übertragen (Reinehr et al. 2019).
Im EAG-Modell untersuchten wir bisher verschiedene Komponenten der Immunantwort und nachfolgende Zelltodmechanismen. Wir konnten bisher zeigen, dass die Immunisierung mit okulären Antigenen zu einem Verlust von retinalen Ganglienzellen und einer Degeneration der Sehnerven führt (Laspas et al. 2011, Joachim et al. 2009,Grotegut et al. 2020,). Interessanterweise kommt es durch die Immunisierung zu einer Vermehrung von Gliazellen in der Retina und im Sehnerv, noch bevor es zum Absterben retinaler Ganglienzellen kommt (Casola et al. 2015, Noristani/Kuehn et al. 2016). Zusätzlich konnten Autoantikörperablagerungen in der Netzhaut gefunden werden (Laspas et al. 2011), die beispielsweise das Komplementsystem aktivieren (Reinehr et al. 2016, 2018).
Basierend auf der Glia- und Komplementtaktivierung wurden in unsere Arbeitsgruppe in den letzten Jahren auch verschiedene therapeutische Ansätze, wie eine Komplementinhibition mittels C5-Inhibitors (Reinehr et al. 2019) oder eine Mikrogliainhibition via Minocycline (Grotegut et al. 2020) erfolgreich untersucht.
Da fortschreitendes Alter ein Risikofaktor die Entstehung eines Glaukoms erhöht, wurde diese Faktor ebenfalls analysiert. Dazu wurde jungen (1 bis 2 Monate alten) und alten (7 bis 8 Monate alten) Mäusen 4 Wochen nach HSP27 Injektion untersucht. Es zeigte sich, dass die altersabhängigen Effekte nicht sehr ausgeprägt waren, obwohl eine verstärkte Entzündung bei gealterten Mäusen nachweisbar war (Abbildung 1; Erb/Reinehr et al. 2023; Joachim und Reinehr 2024).
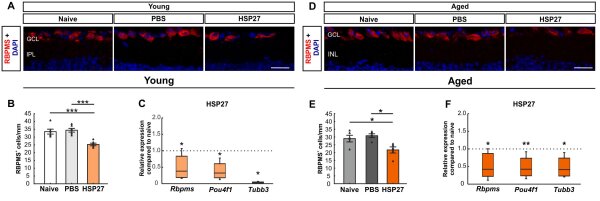
Abbildung 1: Einfluss des Alters im EAG-Modell. (A) RGZ in der Retina junger Mäuse wurden mit RBPMS (rot) markiert, DAPI (blau) wurde zum Färben der Zellkerne verwendet. (B) Die RBPMS-Zellzählung ergab eine signifikante Verringerung der RGZ-Anzahl in der HSP27-Gruppe im Vergleich zur naiven und zur PBS-Gruppe (beide p<0,001). (C) Eine signifikante Herunterregulierung der Rbpms-, Pou4f1- und Tubb3-mRNA-Expression wurde in der HSP27-Gruppe im Vergleich zu naiven und PBS-Mäusen festgestellt (alle p<0,050). (D) RGZ gealterter Mäuse wurden mit RBPMS (rot) markiert, während DAPI (blau) zum Gegenfärben der Zellkerne verwendet wurde. (E) Die Zahl der RGZ war bei gealterten HSP27-Mäusen im Gegensatz zu naiven und PBS-Mäusen signifikant verringert (beide p<0,050). (F) HSP27-Mäuse zeigten eine signifikante Herunterregulierung von Rbpms (p<0,050), Pou4f1 (p<0,010) und Tubb3 (p<0,050) im Vergleich zu Kontroll-Retinae. Maßstäbe: 20 µm. Werte für die Immunhistologie sind Mittelwerte±SEM und jedes Symbol stellt einen einzelnen Datenpunkt dar. Werte für RT-PCR Median±Quartile±Min/Max. Die gepunkteten Linien in C und F stellen die Werte der jeweiligen Kontrollgruppen dar. *p<0,050, **p<0,010, ***p<0,001. Abkürzungen: GCL=Ganglienzellschicht, IPL=innere plexiforme Schicht, INL=innere Körnerschicht, RGZ=Retinale Ganglienzellen (Erb/Reinehr et al. 2023).
MODELLE DES PRIMÄREN HOCHDRUCKGLAUKOMS
Der Hauptrisikofaktor für die Entstehung eines Glaukoms ist ein erhöhter Augeninnendruck. Das sogenannte βB1-CTGF-Hochdruckglaukommodell ermöglicht die Untersuchung dieses Risikofaktors. Die Überexpression von CTGF (= Connective Tissue Growth Factor) führt zu einer Versteifung des Trabekelwerks und damit zu einer Behinderung des Kammerwasserabflusses. Ein Vorteil dieses Modells ist, dass es den Augeninnendruck ohne äußere chirurgische Manipulation erhöht.
Bereits im Alter von 4 Wochen war ein signifikanter Verlust von Sehnervenfasern zu beobachten (Junglas et al. 2012). In unserer Arbeitsgruppe konnten wir zudem zeigen, dass nach 15 Wochen auch der Augeninnendruck der Tiere erhöht und die Anzahl der Ganglienzellen deutlich reduziert ist (Reinehr et al. 2019). Dieses Modell scheint daher gut geeignet, um mögliche druckabhängigen Mechanismen, die auch beim menschlichen Glaukom auftreten, analysieren zu können.
KOMBINATIONSMODELL AUS EAG- und βB1-CTGF-MODELL
Da es sich bei dem Glaukom um eine multifaktorielle Erkrankung handelt, war es das Ziel ein Modellsystem zu entwickeln, das den Risikofaktor Hochdruck mit dem Faktor der immunologischen Komponente verbindet.
Dazu wurde das βB1-CTGF-Modell mit dem EAG-Modell kombiniert, indem βB1-CTGF-Mäuse zusätzlich eine intraperitoneale Injektion von bovinen Sehnervenhomogenat erhielten (ONA). Sechs Wochen nach der Immunisierung zeigte sich, dass die Mäuse des Kombinationsmodell eine signifikant niedrigere Anzahl an retinalen Ganglienzellen und eine ausgeprägtere Degeneration des Sehnervs aufweisen (Reinehr et al. 2023, Kluge und Reinehr 2024). Damit eignet sich das Kombinationsmodell hervorragend, um die multifaktorielle Pathogenese des Glaukoms weiter zu entschlüsseln.