Dr. Daniel Tapken, Dipl.-Biochem., Akad. Rat
Forschungsschwerpunkt
Pflanzliche Glutamatrezeptorhomologe
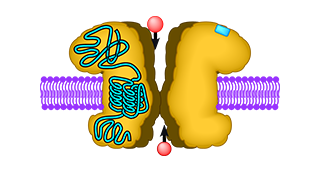
Ionotrope Glutamatrezeptoren sind in Tieren bereits seit vielen Jahrzehnten bekannt. Im Gehirn von Wirbeltieren spielen diese ligandenaktivierten Ionenkanäle eine entscheidende Rolle in der Kommunikation zwischen Nervenzellen. Die Senderzelle schüttet dabei an der Kontaktstelle mit der Empfängerzelle den Botenstoff Glutamat aus. Der aktiviert an der Oberfläche der Empfängerzelle Glutamatrezeptoren, die daraufhin ihren eingebauten Kanal öffnen und so Ionen in die Zelle strömen lassen. Dies erzeugt ein elektrisches Signal, das anschließend in der Empfängerzelle weitergeleitet wird.
 Im Jahr 1998 entdeckte man auch in der Pflanze Arabidopsis thaliana mögliche Glutamatrezeptorgene. Das war ein überraschender Fund, weil Pflanzen kein Nervensystem oder gar Gehirn haben. Dennoch besitzt Arabidopsis sogar zwei Glutamatrezeptorgene mehr als Wirbeltiere, wie sich nach der Sequenzierung ihres Erbgutes im Jahr 2000 herausstellte. Die Proteine, die von diesen Genen kodiert und als GLRs (glutamate-like receptors, glutamatähnliche Rezeptoren) bezeichnet werden, ähneln den Glutamatrezeptoren der Tiere sowohl in ihrer Sequenz als auch in ihrer vorhergesagten Struktur. Diese strukturelle Ähnlichkeit legte die Vermutung nahe, daß auch ihre Funktion ähnlich ist.
Im Jahr 1998 entdeckte man auch in der Pflanze Arabidopsis thaliana mögliche Glutamatrezeptorgene. Das war ein überraschender Fund, weil Pflanzen kein Nervensystem oder gar Gehirn haben. Dennoch besitzt Arabidopsis sogar zwei Glutamatrezeptorgene mehr als Wirbeltiere, wie sich nach der Sequenzierung ihres Erbgutes im Jahr 2000 herausstellte. Die Proteine, die von diesen Genen kodiert und als GLRs (glutamate-like receptors, glutamatähnliche Rezeptoren) bezeichnet werden, ähneln den Glutamatrezeptoren der Tiere sowohl in ihrer Sequenz als auch in ihrer vorhergesagten Struktur. Diese strukturelle Ähnlichkeit legte die Vermutung nahe, daß auch ihre Funktion ähnlich ist.
 Die Erforschung der Funktion erwies sich jedoch als ungewöhnlich schwierig. Lange Zeit waren nur Analysen in der Pflanze erfolgreich, die aber keine direkte Charakterisierung der molekularen Eigenschaften einzelner GLR-Untereinheiten erlaubten. In einigen Fällen ließen sich die beobachteten Effekte nicht einmal mit letzter Sicherheit auf GLRs zurückführen. Insgesamt ergab sich ein sehr vielfältiges Bild möglicher Funktionen, darunter die Regulation des Kohlenstoff- und Stickstoffstoffwechsels, des Hormonhaushalts und der Wasser- und Ionenverteilung innerhalb der Pflanze sowie die Reaktion auf verschiedene Streßeinflüsse aus der Umwelt. Die Untersuchung einzelner, isolierter GLR-Proteine blieb dagegen lange erfolglos. Daher war unklar, ob sie tatsächlich ähnlich wie die Glutamatrezeptoren der Tiere funktionieren, also durch einen Botenstoff wie Glutamat aktiviert werden und daraufhin einen eingebauten Ionenkanal öffnen, der in der Zelle ein elektrisches Signal auslöst.
Die Erforschung der Funktion erwies sich jedoch als ungewöhnlich schwierig. Lange Zeit waren nur Analysen in der Pflanze erfolgreich, die aber keine direkte Charakterisierung der molekularen Eigenschaften einzelner GLR-Untereinheiten erlaubten. In einigen Fällen ließen sich die beobachteten Effekte nicht einmal mit letzter Sicherheit auf GLRs zurückführen. Insgesamt ergab sich ein sehr vielfältiges Bild möglicher Funktionen, darunter die Regulation des Kohlenstoff- und Stickstoffstoffwechsels, des Hormonhaushalts und der Wasser- und Ionenverteilung innerhalb der Pflanze sowie die Reaktion auf verschiedene Streßeinflüsse aus der Umwelt. Die Untersuchung einzelner, isolierter GLR-Proteine blieb dagegen lange erfolglos. Daher war unklar, ob sie tatsächlich ähnlich wie die Glutamatrezeptoren der Tiere funktionieren, also durch einen Botenstoff wie Glutamat aktiviert werden und daraufhin einen eingebauten Ionenkanal öffnen, der in der Zelle ein elektrisches Signal auslöst.
 Im Jahr 2008 konnten wir nachweisen, daß einige der GLR-Proteine tatsächlich einen funktionellen Ionenkanal besitzen. Dazu bauten wir den Teil des pflanzlichen Proteins, der vermutlich den Ionenkanal bildet, in einen tierischen Glutamatrezeptor anstelle seines eigenen Ionenkanals ein. Die Glutamatbindestelle blieb dabei erhalten, so daß sich der Rezeptor durch Glutamat aktivieren ließ. Auf diese Weise untersuchten wir die vermuteten Ionenkanalabschnitte von 17 GLR-Untereinheiten und erhielten in zwei Fällen einen chimären Rezeptor, der bei Aktivierung durch Glutamat Ionen in die Zelle strömen ließ. Damit war gezeigt, daß GLRs aus Arabidopsis prinzipiell Ionenkanäle bilden können.
Im Jahr 2008 konnten wir nachweisen, daß einige der GLR-Proteine tatsächlich einen funktionellen Ionenkanal besitzen. Dazu bauten wir den Teil des pflanzlichen Proteins, der vermutlich den Ionenkanal bildet, in einen tierischen Glutamatrezeptor anstelle seines eigenen Ionenkanals ein. Die Glutamatbindestelle blieb dabei erhalten, so daß sich der Rezeptor durch Glutamat aktivieren ließ. Auf diese Weise untersuchten wir die vermuteten Ionenkanalabschnitte von 17 GLR-Untereinheiten und erhielten in zwei Fällen einen chimären Rezeptor, der bei Aktivierung durch Glutamat Ionen in die Zelle strömen ließ. Damit war gezeigt, daß GLRs aus Arabidopsis prinzipiell Ionenkanäle bilden können.
 Im Anschluß konzentrierten wir uns auf die beiden GLR-Untereinheiten, für die wir in den Chimärenexperimenten einen funktionellen Ionenkanal identifiziert hatten. Die vollständigen pflanzlichen Rezeptoren reagierten nicht auf Glutamat, einer von ihnen ließ sich aber durch eine Reihe anderer Aminosäuren aktivieren, was den Einstrom von Ionen in die Zelle bewirkte. Damit war nachgewiesen, daß zumindest diese GLR-Untereinheit, GLR1.4, ein ligandenaktivierter Ionenkanal ist, der ähnlich funktioniert wie die Glutamatrezeptoren aus Tieren. Eine ungewöhnliche Eigenschaft ist aber, daß nicht nur ein definierter Botenstoff den Rezeptor aktivieren kann, sondern mehrere verschiedene, aber miteinander verwandte Substanzen. Weil Glutamat unwirksam ist, kann GLR1.4 nicht als Glutamatrezeptor bezeichnet werden. Inzwischen wurden auch für eine weitere GLR-Untereinheit ähnliche Eigenschaften gefunden; auch sie ist ein Ionenkanal, der durch mehrere Aminosäuren aktiviert wird, allerdings durch andere als der von uns charakterisierte GLR1.4.
Im Anschluß konzentrierten wir uns auf die beiden GLR-Untereinheiten, für die wir in den Chimärenexperimenten einen funktionellen Ionenkanal identifiziert hatten. Die vollständigen pflanzlichen Rezeptoren reagierten nicht auf Glutamat, einer von ihnen ließ sich aber durch eine Reihe anderer Aminosäuren aktivieren, was den Einstrom von Ionen in die Zelle bewirkte. Damit war nachgewiesen, daß zumindest diese GLR-Untereinheit, GLR1.4, ein ligandenaktivierter Ionenkanal ist, der ähnlich funktioniert wie die Glutamatrezeptoren aus Tieren. Eine ungewöhnliche Eigenschaft ist aber, daß nicht nur ein definierter Botenstoff den Rezeptor aktivieren kann, sondern mehrere verschiedene, aber miteinander verwandte Substanzen. Weil Glutamat unwirksam ist, kann GLR1.4 nicht als Glutamatrezeptor bezeichnet werden. Inzwischen wurden auch für eine weitere GLR-Untereinheit ähnliche Eigenschaften gefunden; auch sie ist ein Ionenkanal, der durch mehrere Aminosäuren aktiviert wird, allerdings durch andere als der von uns charakterisierte GLR1.4.
Der größte Teil der pflanzlichen Glutamatrezeptorhomologe ist jedoch noch immer völlig uncharakterisiert, ihre Funktionen in der Pflanze sind weitgehend unklar, und auch die ungewöhnlichen Eigenschaften der bisher untersuchten Untereinheiten sind nicht im Detail verstanden. Wir arbeiten in unserer Gruppe daran, einige der offenen Fragen zu beantworten und damit zum besseren Verständnis der weiterhin relativ mysteriösen Familie der pflanzlichen GLR-Proteine beizutragen.
Publikationen
- D.C. Ung, N. Pietrancosta, E.B. Badillo, B. Raux, D. Tapken, A. Zlatanovic, A. Doridant, B. Pode-Shakked, A. Raas-Rothschild, O. Elpeleg, B. Abu-Libdeh, N. Hamed, M.-A. Papon, S. Marouillat, R.-A. Thépault, G. Stevanin, J. Elegheert, M. Letellier, M. Hollmann, B. Lambolez, L. Tricoire, A. Toutain, R. Hepp, and F. Laumonnier (2024).
GRID1/GluD1 homozygous variants linked to intellectual disability and spastic paraplegia impair mGlu1/5 receptor signaling and excitatory synapses.
Molecular Psychiatry 29: 1205-1215.
doi: 10.1038/s41380-024-02469-w
Abstract
- G. Gutti, J. Leifeld, R. Kakarla, N.G. Bajad, A. Ganeshpurkar, A. Kumar, S. Krishnamurthy, C. Klein-Schmidt, D. Tapken, M. Hollmann, and S.K. Singh (2023).
Discovery of triazole-bridged aryl adamantane analogs as an intriguing class of multifunctional agents for treatment of Alzheimer's disease.
European Journal of Medicinal Chemistry 259: 115670.
doi: 10.1016/j.ejmech.2023.115670
Abstract
- M. Masternak, A. Koch, S. Laulumaa, D. Tapken, M. Hollmann, F.S. Jørgensen, and J.S. Kastrup (2023).
Differences between the GluD1 and GluD2 receptors revealed by GluD1 X-ray crystallography, binding studies and molecular dynamics.
FEBS Journal 290(15): 3781-3801.
doi: 10.1111/febs.16631
Abstract
- H. Pan, A.A. Steixner-Kumar, A. Seelbach, N. Deutsch, A. Ronnenberg, D. Tapken, N. von Ahsen, M. Mitjans, H. Worthmann, R. Trippe, C. Klein-Schmidt, N. Schopf, K. Rentzsch, M. Begemann, J. Wienands, W. Stöcker, K. Weissenborn, M. Hollmann, K.-A. Nave, F. Lühder, and H. Ehrenreich (2021).
Multiple inducers and novel roles of autoantibodies against the obligatory NMDAR subunit NR1: a translational study from chronic life stress to brain injury.
Molecular Psychiatry 26: 2471-2482
doi: 10.1038/s41380-020-0672-1
Abstract
- H. Pan, B. Oliveira, G. Saher, E. Dere, D. Tapken, M. Mitjans, J. Seidel, J, Wesolowski, D. Wakhloo, C. Klein-Schmidt, A. Ronnenberg, K. Schwabe, R. Trippe, K. Mätz-Rensing, S. Berghoff, Y. Al-Krinawe, H. Martens, M. Begemann, W. Stöcker, F.-J. Kaup, R. Mischke, S. Boretius, K.-A. Nave, J.K. Krauss, M. Hollmann, F. Lühder, and H. Ehrenreich (2019).
Uncoupling the widespread occurrence of anti-NMDAR1 autoantibodies from neuropsychiatric disease in a novel autoimmune model.
Molecular Psychiatry 24: 1489-1501.
doi: 10.1038/s41380-017-0011-3
Abstract
- J. Borycz, A. Ziegler, J.A. Borycz, G. Uhlenbrock, D. Tapken, L. Caceres, M. Hollmann, B.T. Hovemann, I.A. Meinertzhagen (2018).
Location and functions of Inebriated in the Drosophila eye.
Biology Open 7(7): bio034926.
doi: 10.1242/bio.034926
Abstract
- D. Tapken, T.B. Steffensen, R. Leth, L.B. Kristensen, A. Gerbola, M. Gajhede, F.S. Jørgensen, L. Olsen, and J.S. Kastrup (2017).
The low binding affinity of D-serine at the ionotropic glutamate receptor GluD2 can be attributed to the hinge region.
Scientific Reports 7: 46145.
doi: 10.1038/srep46145
Abstract
- E. Castillo-Gómez, B. Oliveira, D. Tapken, S. Bertrand, C. Klein-Schmidt, H. Pan, P. Zafeiriou, J. Steiner, B. Jurek, R. Trippe, H. Prüss, W.-H. Zimmermann, D. Bertrand, H. Ehrenreich, and M. Hollmann (2017).
All naturally occurring autoantibodies against the NMDA receptor subunit NR1 have pathogenic potential irrespective of epitope and immunoglobulin class.
Molecular Psychiatry 22: 1776-1784.
doi: 10.1038/mp.2016.125
Abstract Pressemitteilung
- A.P. Larsen, P. Francotte, K. Frydenvang, D. Tapken, E. Goffin, P. Fraikin, D.H. Caignard, P. Lestage, L. Danober, B. Pirotte, and J.S. Kastrup (2016).
Synthesis and pharmacology of mono-, di- and trialkyl-substituted 7-chloro-3,4-dihydro-2H-1,2,4-benzothiadiazine 1,1-dioxides combined with X-ray structure analysis to understand the unexpected structure-activity relationship at AMPA receptors.
ACS Chemical Neuroscience 7(3): 378-390.
doi: 10.1021/acschemneuro.5b00318
Abstract
- N. Krogsgaard-Larsen, M. Storgaard, C. Møller, C.S. Demmer, J. Hansen, L. Han, R.N. Monrad, B. Nielsen, D. Tapken, D.S. Pickering, J.S. Kastrup, K. Frydenvang, and L. Bunch (2015).
Structure–activity relationship study of ionotropic glutamate receptor antagonist (2S,3R)-3-(3-carboxyphenyl)pyrrolidine-2-carboxylic acid.
Journal of Medicinal Chemistry 58(15): 6131-6150.
doi: 10.1021/acs.jmedchem.5b00750
Abstract
- S. Pahl, D. Tapken, S.C. Haering, and M. Hollmann (2014).
Trafficking of kainate receptors.
Membranes 4(3): 565-595.
doi: 10.3390/membranes4030565
Abstract
- S.C. Haering, D. Tapken, S. Pahl, and M. Hollmann (2014).
Auxiliary subunits: Shepherding AMPA receptors to the plasma membrane.
Membranes 4(3): 469-490.
doi: 10.3390/membranes4030469
Abstract
- D. Tapken, U. Anschütz, L.-H. Liu, T. Huelsken, G. Seebohm, D. Becker, and M. Hollmann (2013).
A plant homolog of animal glutamate receptors is an ion channel gated by multiple hydrophobic amino acids.
Science Signaling 6(279): ra47.
doi: 10.1126/scisignal.2003762
Abstract Pressemitteilung

- A. Orth, D. Tapken, and M. Hollmann (2013).
The delta subfamily of glutamate receptors: characterization of receptor chimeras and mutants.
European Journal of Neuroscience 37(10): 1620-1630.
doi: 10.1111/ejn.12193
Abstract
- T. Huelsken, D. Tapken, T. Dahlmann, H. Wägele, C. Riginos, and M. Hollmann (2012).
Systematics and phylogenetic species delimitation within Polinices s.l. (Caenogastropoda: Naticidae) based on molecular data and shell morphology.
Organisms Diversity and Evolution 12(4): 349-375.
doi: 10.1007/s13127-012-0111-5
Abstract
- E. Wrobel, D. Tapken, and G. Seebohm (2012).
The KCNE tango – how KCNE1 interacts with Kv7.1.
Frontiers in Pharmacology 3: 142.
doi: 10.3389/fphar.2012.00142
Abstract
- G. Seebohm, N. Strutz-Seebohm, O.N. Ursu, R. Preisig-Müller, M. Zuzarte, E.V. Hill, M.-C. Kienitz, S. Bendahhou, M. Fauler, D. Tapken, N. Decher, A. Collins, K. Jurkat-Rott, K. Steinmeyer, F. Lehmann-Horn, J. Daut, J.M. Tavaré, L. Pott, W. Bloch, and F. Lang (2012).
Altered stress stimulation of inward-rectifier potassium channels in Andersen-Tawil syndrome.
The FASEB Journal 26(2): 513-522.
doi: 10.1096/fj.11-189126
Abstract
- N. Strutz-Seebohm, M. Pusch, S. Wolf, R. Stoll, D. Tapken, K. Gerwert, B. Attali, and G. Seebohm (2011).
Structural basis of slow activation gating in the cardiac IKs channel complex.
Cellular Physiology and Biochemistry 27(5): 443-452.
doi: 10.1159/000329965
Abstract
- Z.-L. Ma-Högemeier, C. Körber, M. Werner, D. Racine, E. Muth-Köhne, D. Tapken, and M. Hollmann (2010).
Oligomerization in the endoplasmic reticulum and intracellular trafficking of kainate receptors are subunit- but not editing-dependent.
Journal of Neurochemistry 113(6): 1403-1415.
doi: 10.1111/j.1471-4159.2009.06559.x
Abstract
- C. Sager, D. Tapken, and M. Hollmann (2010).
The C-terminal domains of TARPs: Unexpectedly versatile domains.
Channels 4(3): 155-158.
doi: 10.4161/chan.4.3.11349
Abstract
- N. Strutz-Seebohm, U. Henrion, K. Steinke, D. Tapken, F. Lang, and G. Seebohm (2009).
Serum- and glucocorticoid-inducible kinases (SGK) regulate KCNQ1/KCNE potassium channels.
Channels 3(2): 88-90.
doi: 10.4161/chan.3.2.8086
- S. Kott, C. Sager, D. Tapken, M. Werner, and M. Hollmann (2009).
Comparative analysis of the pharmacology of GluR1 in complex with TARPs γ2, γ3, γ4, and γ8.
Neuroscience 158(1): 78-88 (Special issue “Protein Trafficking, Targeting, and Interaction at the Glutamate Synapse”).
doi: 10.1016/j.neuroscience.2007.12.047
Abstract
- C. Sager, D. Tapken, S. Kott, and M. Hollmann (2009).
Functional modulation of AMPA receptors by transmembrane AMPA receptor regulatory proteins.
Neuroscience 158(1): 45-54 (Special issue “Protein Trafficking, Targeting, and Interaction at the Glutamate Synapse”).
doi: 10.1016/j.neuroscience.2007.12.046
Abstract
- G. Seebohm, N. Strutz-Seebohm, O.N. Ureche, U. Henrion, R. Baltaev, A.F. Mack, G. Korniychuk, K. Steinke, D. Tapken, A. Pfeufer, S. Kääb, C. Bucci, B. Attali, J. Merot, J.M. Tavaré, U.C. Hoppe, M.C. Sanguinetti and F. Lang (2008).
Long QT syndrome-associated mutations in KCNQ1 and KCNE1 subunits disrupt normal endosomal recycling of IKs channels.
Circulation Research 103(12): 1451-1457.
doi: 10.1161/circresaha.108.177360
- D. Tapken and M. Hollmann (2008).
Arabidopsis thaliana glutamate receptor ion channel function demonstrated by ion pore transplantation.
Journal of Molecular Biology 383(1): 36-48.
doi: 10.1016/j.jmb.2008.06.076
Abstract
- D. Tapken and M. Hollmann (2006).
Homologs of mammalian glutamate receptors in invertebrates and plants.
In: Biological and biophysical aspects of ligand-gated ion channel receptor superfamilies, H. Arias, ed. Research Signpost, Trivandrum, pp. 321-382.
Abstract
Berufliche Tätigkeit
- Seit September 2016
- Akademischer Rat am Lehrstuhl für Biochemie I – Rezeptorbiochemie, Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum
- Oktober 2012 bis August 2016
- Wissenschaftlicher Mitarbeiter am Lehrstuhl für Biochemie I – Rezeptorbiochemie, Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum
- Oktober 2011 bis September 2012
- Postdoc mit einem Stipendium der Carlsberg-Stiftung am Institut für Arzneimitteldesign und Pharmakologie, Gesundheitswissenschaftliche Fakultät der Universität Kopenhagen, Dänemark
- Oktober 2010 bis September 2011
- Postdoc mit einem Forschungsstipendium der Deutschen Forschungsgemeinschaft am Institut für Pharmazeutische Chemie, Pharmazeutische Fakultät der Universität Kopenhagen, Dänemark
- September 2008 bis September 2010
- Postdoc am Lehrstuhl für Biochemie I – Rezeptorbiochemie, Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum
Ausbildung
- August 2008
- Promotion zum Dr. rer. nat. an der Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum
- September 2002 bis August 2008
- Doktorarbeit „Molekulare und funktionelle Charakterisierung pflanzlicher Glutamatrezeptoren“ am Lehrstuhl für Biochemie I – Rezeptorbiochemie, Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum
- Juli 2002
- Diplom in Biochemie an der Fakultät für Chemie der Ruhr-Universität Bochum
- November 2001 bis Juli 2002
- Diplomarbeit „Untersuchung von Glutamatrezeptoren aus Arabidopsis thaliana“ am Lehrstuhl für Biochemie I – Rezeptorbiochemie, Fakultät für Chemie der Ruhr-Universität Bochum
- Oktober 1997 bis Juli 2002
- Studium der Biochemie an der Ruhr-Universität Bochum
- Mai 1996
- Abitur am Städtischen Ratsgymnasium in Gladbeck
Lehrtätigkeit
- Seit 2020
- Organisation der biochemischen Praktika im Bachelorstudiengang Biochemie
- Seit 2017
- Vorlesung und Übung „Molekulargenetische Methoden in der Biochemie“ im Bachelorstudiengang Biochemie (4. Fachsemester)
- Seit 2016
- Wahlpraktikum „Methoden der Zellkultur und konfokale Mikroskopie“ im Bachelorstudiengang Biochemie (5. Fachsemester)
- Seit 2014
- Laborpraktikum für Fortgeschrittene im Bachelorstudiengang Biochemie (5. Fachsemester): Vorlesung, Seminar und Methodendemonstration
- Seit 2013
- Vorlesung und Übung „Biochemie II – Biochemie der Nukleinsäuren“ im Bachelorstudiengang Biochemie (4. Fachsemester)
- Biochemisches Seminar im Masterstudiengang Biochemie (1. Fachsemester)
- 2012
- Doktorandenkurs „Receptor Structure and Function“: Workshop zur Differential Scanning Fluorimetry
- Seit 2004
- Betreuung von Bachelor- und Masterarbeiten in den Biochemiestudiengängen
- 2003 bis 2010
- Laborpraktikum für Fortgeschrittene im Bachelorstudiengang Biochemie (5. Fachsemester): Vorlesung und Methodendemonstration
- Seit 2001
- Modulpraktikum „Heterologe Expression von Neurotransmitterrezeptoren in Froschoozyten“ im Masterstudiengang Biochemie (1. Fachsemester), seit 2008 einschließlich Vorlesungen zu theoretischem Hintergrund und angewandten Methoden
Sonstige Tätigkeiten
- 2013 bis 2023
- Fotografische Begleitung der Absolventenfeier der Fakultät für Chemie und Biochemie
- Seit 2003
- Betreuung des Internetauftritts des Lehrstuhls Biochemie I, 2010 komplette Neugestaltung mit Umstellung auf das neue Corporate Design der Ruhr-Universität, 2016 Neugestaltung und seitdem Betreuung des Internetauftritts des Lehrstuhls Biochemie II
- August 1996 bis August 1997
- Zivildienst in der Sozialstation der Arbeiterwohlfahrt Gladbeck
Persönliche Daten
- Geburtsdatum
- 22.02.1977
- Geburtsort
- Bottrop