Modulation von Glutamatrezeptoren durch Hilfsproteine
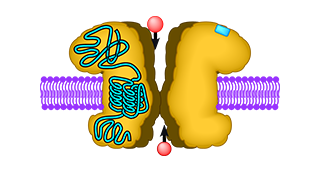
 AMPA-Rezeptoren sind eine Unterfamilie der Glutamatrezeptoren und spielen eine entscheidende Rolle in der schnellen Signalweiterleitung im Gehirn. Obwohl AMPA-Rezeptoren ihre grundlegende Funktion, nämlich bei Bindung von Glutamat Ionen in die Zelle zu leiten, alleine ausüben können, sind an der Feinabstimmung dieses Prozesses eine Reihe anderer Proteine beteiligt. Die meisten dieser Proteine sind insbesondere dazu wichtig, die AMPA-Rezeptoren an ihren korrekten Bestimmungsort zu transportieren, wenn sie dort gebraucht werden, sie aber auch zum richtigen Zeitpunkt wieder zu entfernen. Überraschend war die Entdeckung einer Klasse von sechs kleinen Membranproteinen, die zwar auch an dieser Transportregulierung beteiligt sind, darüber hinaus aber auch direkt die funktionellen Eigenschaften der AMPA-Rezeptoren beeinflussen. Insbesondere verstärken diese transmembranen AMPA-Rezeptor-regulierenden Proteine (TARPs) das durch Glutamat ausgelöste Signal, indem sie den AMPA-Rezeptor-Kanal, durch den die Ionen in die Zelle fließen, länger offen halten. Für das Verständnis der Funktionsweise von AMPA-Rezeptoren ist es von großer Bedeutung, diesen Mechanismus zu verstehen. Wir beschäftigen uns insbesondere damit, die unterschiedlich starken Einflüsse der verschiedenen TARPs auf die AMPA-Rezeptoren zu charakterisieren, und untersuchen die Wechselwirkungen, die dafür verantwortlich sind.
AMPA-Rezeptoren sind eine Unterfamilie der Glutamatrezeptoren und spielen eine entscheidende Rolle in der schnellen Signalweiterleitung im Gehirn. Obwohl AMPA-Rezeptoren ihre grundlegende Funktion, nämlich bei Bindung von Glutamat Ionen in die Zelle zu leiten, alleine ausüben können, sind an der Feinabstimmung dieses Prozesses eine Reihe anderer Proteine beteiligt. Die meisten dieser Proteine sind insbesondere dazu wichtig, die AMPA-Rezeptoren an ihren korrekten Bestimmungsort zu transportieren, wenn sie dort gebraucht werden, sie aber auch zum richtigen Zeitpunkt wieder zu entfernen. Überraschend war die Entdeckung einer Klasse von sechs kleinen Membranproteinen, die zwar auch an dieser Transportregulierung beteiligt sind, darüber hinaus aber auch direkt die funktionellen Eigenschaften der AMPA-Rezeptoren beeinflussen. Insbesondere verstärken diese transmembranen AMPA-Rezeptor-regulierenden Proteine (TARPs) das durch Glutamat ausgelöste Signal, indem sie den AMPA-Rezeptor-Kanal, durch den die Ionen in die Zelle fließen, länger offen halten. Für das Verständnis der Funktionsweise von AMPA-Rezeptoren ist es von großer Bedeutung, diesen Mechanismus zu verstehen. Wir beschäftigen uns insbesondere damit, die unterschiedlich starken Einflüsse der verschiedenen TARPs auf die AMPA-Rezeptoren zu charakterisieren, und untersuchen die Wechselwirkungen, die dafür verantwortlich sind.
Eigene Publikationen zum Thema
- A. Bećić, J. Leifeld, J. Shaukat, and M. Hollmann (2022).
Tetraspanins as potential modulators of glutamatergic synaptic function.
Frontiers in Molecular Neuroscience 14: 801882.
doi: 10.3389/fnmol.2021.801882
Abstract
- S.C. Haering, D. Tapken, S. Pahl, and M. Hollmann (2014).
Auxiliary subunits: Shepherding AMPA receptors to the plasma membrane.
Membranes 4(3): 469-490.
doi: 10.3390/membranes4030469
Abstract
- C. Sager, D. Tapken, and M. Hollmann (2010).
The C-terminal domains of TARPs: Unexpectedly versatile domains.
Channels 4(3): 155-158.
doi: 10.4161/chan.4.3.11349
Abstract
- C. Sager, J. Terhag, S. Kott, and M. Hollmann (2009).
C-terminal domains of transmembrane α-amino-3-hydroxy-5-methyl-4-isoxazole propionate (AMPA) receptor regulatory proteins not only facilitate trafficking but are major modulators of AMPA receptor function.
Journal of Biological Chemistry 284(47): 32413-32424.
doi: 10.1074/jbc.M109.039891
Abstract
- S. Kott, C. Sager, D. Tapken, M. Werner, and M. Hollmann (2009).
Comparative analysis of the pharmacology of GluR1 in complex with TARPs γ2, γ3, γ4, and γ8.
Neuroscience 158(1): 78-88 (Special issue “Protein Trafficking, Targeting, and Interaction at the Glutamate Synapse”).
doi: 10.1016/j.neuroscience.2007.12.047
Abstract
- C. Sager, D. Tapken, S. Kott, and M. Hollmann (2009).
Functional modulation of AMPA receptors by transmembrane AMPA receptor regulatory proteins.
Neuroscience 158(1): 45-54 (Special issue “Protein Trafficking, Targeting, and Interaction at the Glutamate Synapse”).
doi: 10.1016/j.neuroscience.2007.12.046
Abstract
- C. Körber, M. Werner, S. Kott, Z.-L. Ma, and M. Hollmann (2007).
The transmembrane AMPA receptor regulatory protein γ4 is a more effective modulator of AMPA receptor function than stargazin (γ2).
Journal of Neuroscience 27(31): 8442-8447.
doi: 10.1523/jneurosci.0424-07.2007
Abstract
- C. Körber, M. Werner, J. Hoffmann, C. Sager, M. Tietze, S.M. Schmid, S. Kott, and M. Hollmann (2007).
Stargazin interaction with α-amino-3-hydroxy-5-methyl-4-isoxazole propionate (AMPA) receptors is critically dependent on the amino acid at the narrow constriction of the ion channel.
Journal of Biological Chemistry 282(26): 18758-18766.
doi: 10.1074/jbc.M611182200
Abstract
- S. Kott, M. Werner, C. Körber, and M. Hollmann (2007).
Electrophysiological properties of AMPA receptors are differentially modulated depending on the associated member of the TARP family.
Journal of Neuroscience 27(14): 3780-3789.
doi: 10.1523/jneurosci.4185-06.2007
Abstract Pressemitteilung
Doktorarbeiten zum Thema
- Peer Henning Höcker
Identifizierung für die AMPA-Rezeptormodulation relevanter Domänen von Stargazin
März 2012 bis April 2017
- Sandra Lemos
Modulation von AMPA-Rezeptoren durch Typ-II-TARPs
April 2011 bis März 2017
Arbeit als pdf herunterladen (7,2 MB)
- Jan Terhag
Hilfsuntereinheiten spannungsaktivierter Calciumkanäle als Modulatoren ionotroper Glutamatrezeptoren
Oktober 2008 bis Juni 2016
Arbeit als pdf herunterladen (51,2 MB)
- Simon Haering
Identifikation und funktionelle Charakterisierung von Claudinuntereinheiten als neue transmembrane AMPA-Rezeptor-regulierende Proteine
November 2010 bis September 2015
Arbeit als pdf herunterladen (22,8 MB)
- Charlotte Sager
Untersuchungen zur Wechselwirkung von AMPA-Rezeptoren mit TARPs
Oktober 2006 bis Juli 2010
Arbeit als pdf herunterladen (5,4 MB)
- Sabine Kott
Charakterisierung der funktionellen Modulation von AMPA-Rezeptoren durch TARPs
März 2003 bis Juli 2008
Arbeit als pdf herunterladen (2,8 MB)
Diplom- und Masterarbeiten zum Thema
- Hua Tan
Untersuchung von AMPAR-Stargazin-Wechselwirkungen mittels Reassemblierung geteilten GFPs
24.02.2014 bis 24.08.2014
- Tobias Strasdeit
Elektrophysiologische Untersuchungen neuer glutamatrezeptormodulierender Proteine
23.07.2013 bis 29.07.2014
- Peer Henning Höcker
Studien zum Mechanismus der Modulation von AMPA-Rezeptoren durch Typ-I-TARPs
01.10.2010 bis 24.10.2011
- Christoph Körber
Modulation der elektrophysiologischen Eigenschaften von AMPA-Rezeptoren durch TARPs
01.03.2006 bis 27.09.2006
- Charlotte Sager
Charakterisierung der differentiellen Modulation von AMPA-Rezeptoren durch TARPs
01.03.2006 bis 31.08.2006
Bachelorarbeiten zum Thema
- Jennifer Leifeld
Identifikation von TARP-Domänen, die mit AMPA-Rezeptoren interagieren
Betreuer: Peer Henning Höcker
- Lena Schüle
Modulation heteromerer Kainatrezeptoren durch NETO-Proteine
Betreuer: Steffen Pahl
- Oliver Lampret
Untersuchungen zur funktionellen Modulation von NMDA-Rezeptoren durch interagierende Membranproteine
Betreuer: Simon Kösters
- Felix Kipper
Untersuchungen zur funktionellen Bedeutung konservierter Serinreste in der C-terminalen Domäne des TARPs γ2
Betreuer: Peer Henning Höcker
- Isabella Tolle
Funktionale Modulation von NMDA-Rezeptoren durch die akzessorischen Untereinheiten CKAMP44a und CKAMP44b
17.09.2012
Betreuer: Simon Kösters
- Daniela Keinhörster
Elektrophysiologische Untersuchungen einer möglichen Modulation von AMPA- und NMDA-Rezeptoren durch NETO-Proteine
10.09.2012
Betreuer: Steffen Pahl
- David Gnutt
Das Chaperon GRP78 als möglicher Interaktionspartner ionotroper Glutamatrezeptoren
07.11.2011
Betreuer: Jan Terhag
- Sebastian Becker
Funktionelle Modulation von Punktmutanten des AMPA-Rezeptors GluA1 durch TARPs
21.09.2011
Betreuer: Simon Kösters
- Daniel Niedieker
Modulation des AMPA-Rezeptors GluR1 durch die α2δ-Untereinheit spannungsgesteuerter Calciumkanäle
09.2010
Betreuer: Jan Terhag
- Alina Dressler
Bedeutung der Ex1-Domäne von Stargazin für die Modulation der AMPA-Rezeptorfunktion
05.10.2009
Betreuerin: Charlotte Sager
- Ellen Kloosterboer
Generierung und Charakterisierung trunkierter Stargazin-Proteine
01.10.2009
Betreuerin: Dr. Sabine Kott
- Markus Sudbrock
Klonierung eines AMPA-Rezeptor-Stargazin-Fusionsproteins und dessen Expression in Xenopus-Oozyten
11.08.2005
Betreuer: Dr. Ralf Trippe
- Romy Marx
Der Effekt von Stargazin auf die Expression des Glutamatrezeptors GluR1(Q)flip
23.06.2004
Betreuer: Dr. Ralf Trippe


 Javeria Shaukat
Javeria Shaukat Jennifer Leifeld
Jennifer Leifeld Sebastian Obst
Sebastian Obst Dr. Tobias Strasdeit
Dr. Tobias Strasdeit Dr. Peer Henning Höcker
Dr. Peer Henning Höcker Dr. Markus Werner
Dr. Markus Werner Dr. Sandra Lemos
Dr. Sandra Lemos Dr. Jan Terhag
Dr. Jan Terhag Dr. Steffen Pahl
Dr. Steffen Pahl Dr. Simon Haering
Dr. Simon Haering Dr. Charlotte Sager
Dr. Charlotte Sager Dr. Sabine Kott
Dr. Sabine Kott Christoph Körber
Christoph Körber